こんにちは。レビュープロの近藤です。
医薬品・医療機器のプロモーション資材審査の業務を取り扱っています。
前回(2023年2月20日)の解説では、「資材化できる臨床論文」は、以下のチェックポイントをクリアする必要があることを紹介しました。
- 使用されている自社品が国内の承認の範囲内か。
- 事前に規定された解析計画に基づく解析結果であるか。
- 論文が査読を経たものであるか。
- 利益相反が確認できるか。
今回の記事を見ているあなたは、次の段階として、「資材に掲載できる臨床試験成績」について知りたいと思っている方ではないでしょうか?
原著論文を選択して、自社品の臨床試験成績を資材に掲載する場合、以下の点をあらかじめ点検する必要があります。
- 試験はどのようなデザインで行われているか。
- 試験結果に対する統計学的解析結果と統計解析手法が確認できるか。
試験はどのようなデザインで行われているか。
皆さんよくご存知のことと思いますが、臨床研究と一口に言っても、エビデンスレベル、つまり科学的根拠・医学的根拠の信頼性の程度でみると、強弱があります。
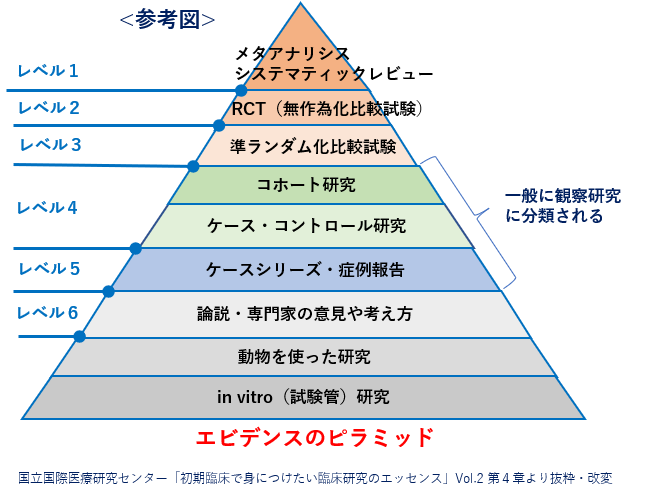
エビデンスレベルのピラミッドでみると、レベル1からレベル3が、エビデンスレベルが最も高いと言われており、「無作為化比較試験」などがこれにあたります。
通常、二重盲検比較試験で行われる治験による「承認時評価資料」もこのレベルに入っていると解釈されます。
これに対して、「前向き・後向きコホート研究」などの観察研究はレベル4に相当し、科学的根拠の信頼性で言うと低くなります。
さらに同じ観察研究でも、「症例報告」などになると、エビデンスレベルはさらに低下します。
製薬協作成要領では、資材に掲載できる「他社品との比較試験成績」については、厳しい規定が設定されています。
具体的には、前回に紹介した「資材化できる臨床論文」の条件に加えて、以下の条件のいずれかを満たしていることが必要です。
- 二重盲検比較試験
- 承認審査過程において二重盲検比較試験に代わる資料として提出され、評価を受けたもの
- 無作為化比較試験
これを見ますと、エビデンスレベルで言うと高いレベルの試験の実施が求められており、科学的根拠として信頼性の高い試験によって初めて他社品との比較ができるということになっています。
したがって、「観察研究」では他社品との比較データをプロモーション資材に使用することはできません。
さらに、「症例報告」は、通常のプロモーション資材では、ある例外を除いては、原則的に使用不可となります。
試験結果に対する統計学的解析結果と統計解析手法が確認できるか。
他社品との優劣は、原著論文にコメントがあっても、有意差検定結果と検定方法の確認ができなければ資材に記載はできません。
たとえば、製薬協作成要領では、あいまいな表現として「大きな差はなかった」、「類似している」、「概ね高い」、「傾向が認められた」等の表現は科学的ではなく、誤解をまねくおそれがあるため、その使用を禁止しています。
ただし、他社品との優劣に触れずに、たとえば「A は〇〇、B は△△だった」のように、試験結果の実数値を示すのみであれば掲載は可能です。
同じように、観察研究では、原著論文に自社品の有効性を認めるようなコメントがあっても、資材において自社品の有効性を訴求するには、統計学的解析結果と統計解析手法の記載が必須になります。
次回は、新規のシリーズとして【ノンプロモーション資材審査Q&Aシリーズ】のVol.1「疾患啓発記事の最近の傾向とその対策とは?」について解説いたします。
株式会社レビュープロでは、プロモーション資材審査だけでなく、医薬品メーカーの広告におけるコンプラインス上のさまざまな疑問点や不明点についてのご相談も受け付けております。
お気楽にご連絡ください。